Viruela del mono: un fármaco mostró buenos resultados, pero recién empiezan los ensayos en humanos
El medicamento se había desarrollado para tratar la viruela humana tras los atentados de 2001 en Estados Unidos. Qué se sabe y qué falta conocer
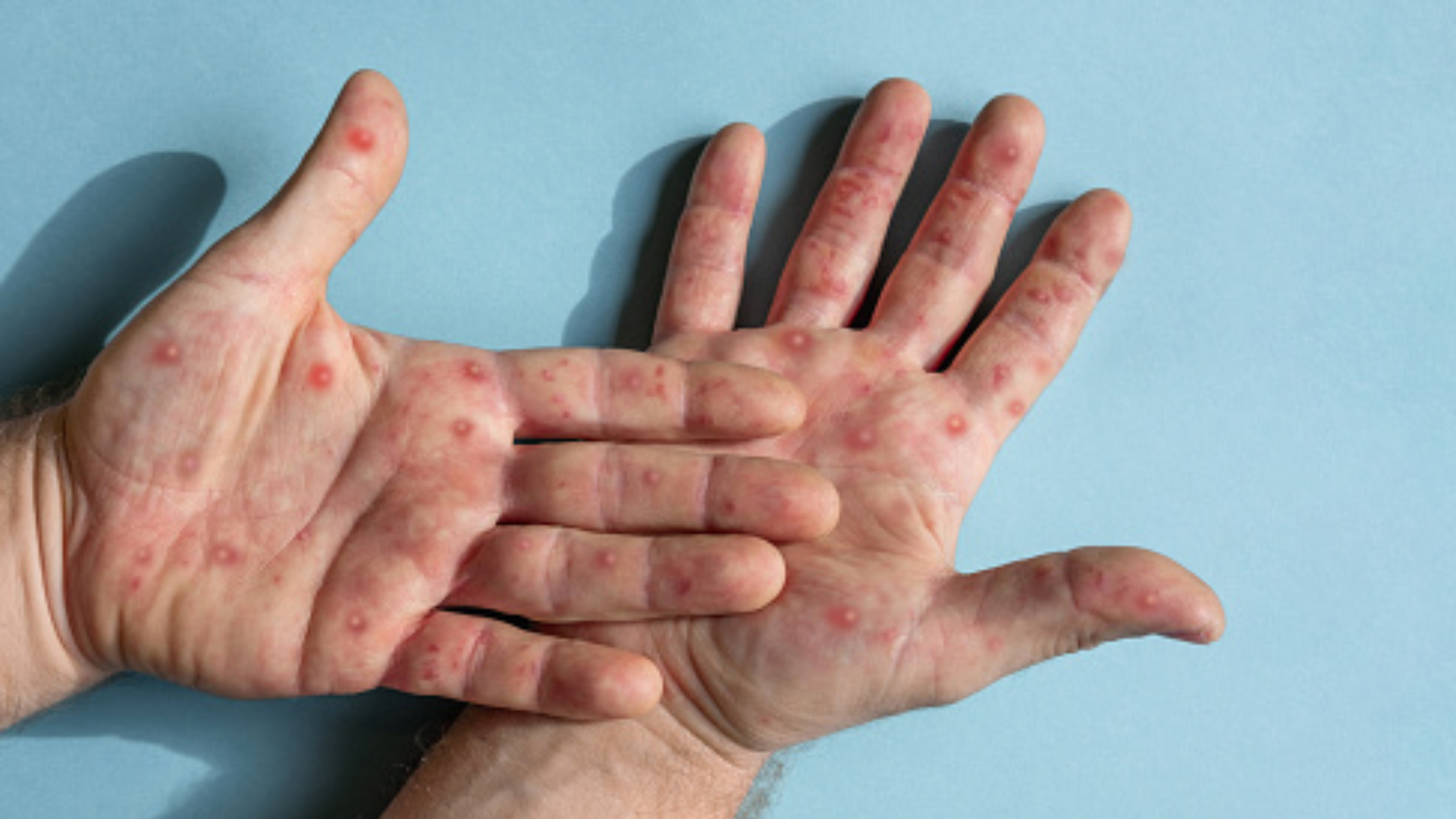
La mayoría de las personas con viruela símica o del mono se recuperan por completo dentro de 2 a 4 semanas sin la necesidad de un tratamiento médico, según los Centros para el Control y la Prevención de las Enfermedades (CDC) de los Estados Unidos.
Como el virus Monkeypox y el de la viruela humana son genéticamente similares, en algunos países desarrollados se está indicando el uso del antiviral tecovirimat para personas con más probabilidades de enfermarse gravemente, como los pacientes con sistemas inmunitarios debilitados. Pero el fármaco no es para todos los pacientes ni el acceso hoy resulta fácil.
Hasta ahora, el antiviral ha demostrado reducir la cantidad de virus y el número de lesiones de viruela llenas de líquido que se forman en su piel a través de estudios realizados en los animales infectados por la viruela del mono. Sin embargo, los datos de eficacia en humanos son mucho más limitados, lo que hace que algunos investigadores y organismos reguladores duden en autorizar el uso generalizado de tecovirimat.
Pero los enfermos de viruela del mono -en particular los que padecen una enfermedad grave, que puede causar dolor extremo, cicatrices y, en raros casos, la muerte- están pidiendo el acceso al medicamento. Si bien los ensayos clínicos del fármaco en voluntarios humanos se están iniciando ahora, aún faltan meses para obtener resultados.
Para entender por qué se llegó a esa situación, hay que retrotraerse al año 2001. Tras los atentados con ántrax en los Estados Unidos en ese año, en los que se enviaron cartas con esporas de la letal bacteria a medios de comunicación y políticos, el Instituto Nacional de Alergia y Enfermedades Infecciosas de Estados Unidos, con sede en Bethesda, recibió un impulso financiero para desarrollar tratamientos contra patógenos con potencial para ser utilizados como armas biológicas.

Los funcionarios de bioseguridad estaban especialmente preocupados por la viruela humana, que puede matar a cerca del 30% de las personas infectadas. Aunque la enfermedad fue erradicada hace más de 40 años, la preocupación era que el virus de la viruela pudiera ser liberado accidentalmente o convertido en un arma por los laboratorios de todo el mundo donde aún se guardan muestras. Por eso, hubo inversión en investigación que ayudó a que se desarrollar el fármaco tecovirimat.
El antiviral funciona impidiendo que los ortopoxvirus, como el de la viruela humana, produzcan una determinada proteína. Una vez que este tipo de virus secuestra una célula huésped y se replica, los virus recién formados utilizan esta proteína para escapar de la célula infectada y propagarse a otras células. Al impedir que el virus genere la proteína, el tecovirimat “atrapa esencialmente al virus dentro de las células infectadas”, dejando que los anticuerpos y las células T del sistema inmunitario se encarguen de la situación, según explicó Dennis Hruby, director científico de SIGA Technologies, la empresa farmacéutica con sede en Nueva York que fabrica el fármaco tecovirimat, en la revista Nature.
Los investigadores diseñaron el antiviral pensando en la viruela humana. Pero como se dirige a una proteína que utilizan otros ortopoxvirus, incluido el virus de la viruela del mono, los científicos creen que el fármaco podría también tratar la viruela del mono. Como prueba de que el tecovirimat funciona contra la viruela del mono, existe un ensayo realizado en 450 voluntarios en 2018. Noventa de esos voluntarios recibieron un placebo. Se demostró que el fármaco es seguro y tiene pocos efectos secundarios. Pero la demostración de su eficacia contra el ortopoxvirus en humanos ha sido menos explorada.

Cuando la Administración de Alimentos y Medicamentos de Estados Unidos (FDA) consideró la posibilidad de aprobar el fármaco para tratar la viruela del mono en 2018, la agencia reconoció que no sería factible ni ético probarlo con la infección con ese virus o cualquier otro ortopoxvirus en voluntarios. En cambio, la FDA concedió una excepción para permitir a la empresa SIGA utilizar los datos de eficacia de los estudios en animales.
Los investigadores probaron el tecovirimat en primates no humanos infectados con el virus de la viruela del mono y en conejos infectados con el virus de la viruela del conejo. En ambos casos, los animales que recibieron el antiviral cuatro días después de la infección tuvieron una probabilidad mucho mayor de sobrevivir, desarrollaron menos lesiones y tuvieron una carga viral menor en comparación con los que recibieron un placebo. El estudio se publicó la investigación en la revista The New Journal England of Medicine.
Por el momento, el actual brote mundial de viruela del mono sólo ha aportado hasta ahora pruebas anecdóticas de la eficacia del tecovirimat en las personas, según Daniel McQuillen, presidente de la Sociedad Estadounidense de Enfermedades Infecciosas, con sede en Arlington, Virginia.
Un par de estudios observacionales realizados en un puñado de personas con viruela del mono constataron que las nuevas lesiones dejaban de formarse un día después de que los médicos administraran tecovirimat a los pacientes. Además, un estudio en el que se administró el fármaco a 14 personas en la República Centroafricana, donde circula desde hace décadas una cepa más mortal del virus, descubrió que la carga viral de los participantes se redujo significativamente en cuatro días, según un borrador del manuscrito que ha visto Nature. Pero estos estudios no permiten establecer cuál es la verdadera eficacia del fármaco, porque no tenían un grupo de control para comparar los resultados.
Sin embargo, la Unión Europea y el Reino Unido han autorizado el uso del tecovirimat para la viruela del mono utilizando los mismos estudios en animales revisados por la FDA en los Estados Unidos. Eso ha facilitado el acceso al medicamento en algunos países. Hasta ahora la empresa SIGA sólo ha recibido pedidos de 11 países, entre ellos Estados Unidos y Canadá, según Holly Stevens, portavoz de la empresa. Significa que el acceso al fármaco sigue siendo muy limitado, sobre todo en algunas zonas de África Central y Occidental, donde la viruela del mono lleva décadas propagándose y causando el mayor número de muertes.
En Estados Unidos, la FDA no ha autorizado el uso de tecovirimat contra la viruela del mono porque, según la agencia, la enfermedad no ha sido erradicada y, por tanto, todavía es posible probar el medicamento en humanos. Pero los CDC tienen un protocolo de “medicamento en investigación de acceso ampliado (EA-IND)” que permite el uso de Tecovirimat para el tratamiento primario o empírico temprano de las infecciones por ortopoxvirus que no son del virus de la viruela, incluida la viruela del mono, en adultos y niños de todas las edades.
Esto significa que los médicos estadounidenses sólo pueden acceder al fármaco, considerado experimental para la viruela del mono, al solicitar un permiso especial a través de los Centros para el Control y la Prevención de Enfermedades (CDC). Esta burocracia desanimó a muchos médicos a recetar tecovirimat, a pesar de que el país cuenta con una reserva de 1,7 millones de dosis, que están destinadas principalmente a la lucha contra la viruela.
Los trámites implican una enorme carga para los médicos que tienen que hacer malabares con los pacientes, contó Amesh Adalja, especialista en enfermedades infecciosas de la Escuela de Salud Pública Bloomberg de Johns Hopkins en Baltimore, Maryland. Recientemente, los CDC han convertido en opcionales algunos de los formularios y han permitido a los médicos presentarlos después de administrar el medicamento a las personas. También está trabajando con la FDA para seguir ajustando el proceso, dijo Scott Pauley, portavoz de los CDC.
La FDA se encuentra en una “posición delicada”, señaló McQuillen. Hay un antecedente cercano: la agencia regulatoria fue criticada cuando autorizó el uso de emergencia de medicamentos como la hidroxicloroquina contra el COVID-19 y resultaron no ser eficaces. Si hace que el tecovirimat sea completamente accesible ahora podría dificultar los ensayos clínicos para determinar la eficacia del fármaco, ya que la gente podría no querer inscribirse si existe la posibilidad de recibir un placebo.
Los primeros ensayos controlados aleatorios se están llevando a cabo en Canadá, la República Democrática del Congo, el Reino Unido y los Estados Unidos. Mientras tanto, hay datos de estudios observacionales. En una investigación publicada en la revista JAMA, expertos en enfermedades infecciosas de la Universidad de California en Davis presentaron los resultados sobre 25 pacientes con viruela del mono a los que se les administró el tratamiento con tecovirimat. “Tenemos datos clínicos muy limitados sobre el uso de tecovirimat para la infección por viruela del mono. Queda mucho por aprender sobre la progresión natural de la enfermedad y sobre cómo pueden afectar el tecovirimat y otros antivirales”, dijo la autora principal, Angel Desai.
El estudio era pequeño y no incluía un grupo de control. Por lo tanto, la evaluación de la eficacia de los antivirales en términos de duración y gravedad de los síntomas fue limitada. Además, el tiempo transcurrido desde la aparición de los síntomas hasta el inicio de la terapia antiviral varió entre los pacientes. Los investigadores pidieron que se realicen estudios a gran escala para explorar la dosis de eficacia de los antivirales y los efectos adversos.